 |
 |
 |
| Historia |
| En 1.825 el danés H.C. Oersted preparó una amalgama de aluminio (aluminio disuelto en mercurio) por reacción de cloruro de aluminio con una amalgama de potasio. Posteriormente destiló el preparado para eliminar el mercurio y obtuvo así aluminio impuro ya que contenía aún una proporción apreciable de mercurio. Entre 1.827 y 1.845, Friedrich Wöhler, un químico alemán, mejoró el procedimiento de Oersted usando potasio metálico: Cl3 Al + 3K = Al + 3ClK Él fue el primero en medir el peso específico del aluminio y mostrar su ligereza.En 1.854 Henri Sainte-Claire Deville, en Francia, obtuvo el metal por reducción del cloruro de aluminio con sodio. Ayudado económicamente por Napoleon III, Deville construyó una planta experimental a gran escala y mostró el aluminio puro en la Exposición de París de 1.855. En 1.886 el norteamericano Hall y el francés Héroult descubrieron sumultáneamente que el óxido de aluminio era soluble en criolita (F6AlNa3) fundida y que la mezcla podía electrolizarse con un rendimiento comercial superior al obtenido por los métodos hasta entonces utilizados. Este descubrimiento produjo un descenso considerable en el precio del aluminio y propició la utilización masiva de este metal. En efecto, en 1.886 la producción mundial de aluminio era menos de 45 kg, y su precio era algo mayor de 11 dólares por kg. En 1.989, por el contrario, la producción mundial estimada de aluminio primario era de 18 millones de toneladas métricas y el precio del aluminio era menos de 2 dólares por kg. Su nombre procede de la palabra alumen con que los romanos designaban a las sustancias con propiedades astringentes. |
 |
| Usos |
| Por su elevada conductividad calorífica, se usa en utensilios de cocina y en los pistones de motores de combustión interna. Su alta resistencia en relación a su peso y su resistencia a la corrosión lo hace útil en la construcción de aeronaves, embarcaciones, en perfiles y otros elementos de construcción, vagones de ferrocarril y chasis de coches y motocicletas y en general para todos aquellos usos en los que se necesiten metales resistentes y ligeros. El peso del cable es muy importante en la transmisión de energía eléctrica de alto voltaje a largas distancias y por ello se usan los conductores de aluminio (en lugar de los de cobre) para tendidos eléctricos en líneas que soportan 700.000 V o más. El papel de aluminio de 0,018 cm de grosor, es de uso doméstico común, ya que protege los alimentos y otros productos perecederos de la descomposición. A causa de su ligereza, facilidad de manejo y compatibilidad con alimentos y bebidas, el aluminio se usa ampliamente como envase en la industria alimentaria. La recuperación y reciclaje de estos recipientes es una medida de conservación de la energía cada vez más importante. Los compuestos de aluminio se usan como los catalizadores (Friedel Craft AlCl3 ), purificación del agua (sulfato de aluminio) y en cerámicas (óxido de aluminio). |
 |
| Propiedades |
| Es un metal blando en estado puro, de color grisáceo y de baja densidad. El aluminio es dúctil y maleable pero a temperatura cercana a su punto de fusión se vuelve quebradizo. Es un buen conductor del calor y la electricidad (de aquí su uso para cables de conducciones eléctricas de alta tensión). El aluminio es un metal fuertemente electropositivo y sumamente reactivo. El aire húmedo lo empaña ligeramente pues se recubre de una fina y compacta capa de óxido que le aisla e impide que siga reaccionando. Por eso, los materiales hechos de aluminio no se oxidan. |
 |
| Valores de las Propiedades |
| Masa atómica |
26,98154 uma |
| Punto de fusión |
933,2 K |
| Densidad |
2698 kg/m³ |
| Dureza |
2,8 |
| Potencial normal de reducción |
- 1,66V Al3+ | Al |
| Conductividad térmica |
237,00 J/m s ºC |
| Conductividad eléctrica |
376,7 (mOhm.cm)-1 |
| Calor específico |
877,8 J/kg ºK |
| Calor de fusión |
10,7 kJ/mol |
| Calor de vaporización |
291,0 kJ/mol |
| Estados de oxidación |
+1, +3 |
| 1ª Energía de Ionización |
577,6 kJ/mol |
| 2ª Energía de Ionización |
1816,6 kJ/mol |
| 3ª Energía de Ionización |
2744,7 kJ/mol |
| Afinidad electrónica |
42,5 kJ/mol |
| Radio Covalente |
1,18 Å |
| Radio iónico |
Al+3 = 0,45 Å |
| Volumen atómico |
10 cm³/mol |
| Polarizabilidad |
8,3 ų |
| Electronegatividad (Pauling) |
1,61 |
|
 |
| Reactividad |
| El aluminio desplaza el hidrógeno de los ácidos y de las bases concentradas, formando por la acción de estas últimas los aluminatos. El metal reduce a muchos otros compuestos metálicos a sus metales libres. Por ejemplo, cuando una mezcla de polvos de aluminio y óxido de hierro se calienta, el aluminio rápidamente quita el oxígeno al óxido de hierro; el calor de la reacción es suficiente para fundir el hierro. Este fenómeno se usa en procesos para soldar hierro. El óxido de aluminio es anfótero (se comporta como ácido y como base ). Los compuestos más importantes son el óxido, el hidróxido y el sulfato. El cloruro de aluminio anhidro es importante en las industrias químicas y del petróleo. Muchas gemas como el rubí y el zafiro consisten principalmente en óxido de aluminio cristalino. |
 |
| Resumen de reactividad |
| Con aire |
Suave; con calor 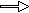 Al2O3 Al2O3 |
| Con H2O |
No reacciona |
| Con HCl 6M |
Suave;  H2 ; AlCl3 H2 ; AlCl3 |
| Con HNO3 15M |
Se vuelve pasivo |
| Con NaOH 6M |
Suave;  H2 ; (Al(OH)4)- H2 ; (Al(OH)4)- |
|
|
 |

 Al2O3
Al2O3